Vaccine-induced human monoclonal antibodies to PfRH5 show broadly neutralizing activity against P. falciparum clinical isolates
Published in Microbiology, Cell & Molecular Biology, and Biomedical Research

Vaccines to the Plasmodium falciparum reticulocyte binding-like protein homologue 5 (PfRH5) target the blood-stage of the parasite life cycle. PfRH5 has the potential to trigger the production of strain-transcendent antibodies and has proven its efficacy both in pre-clinical and early clinical studies. Vaccine-induced monoclonal antibodies to PfRH5 showed promising outcomes against cultured P. falciparum laboratory strains from distinct geographic areas. Here, we assessed the functional impact of vaccine-induced anti-PfRH5 mAbs on more genetically diverse P. falciparum clinical isolates. Our present findings complement earlier reports on the strain transcendent potential of anti-PfRH5 mAbs and constitute, to our knowledge, the first report on the susceptibility of P. falciparum clinical isolates from natural infections to vaccine-induced human mAbs to PfRH5. But the story doesn't end there! Here, we take you Behind the Paper of our recent work, and to do this, we must first take you to Kédougou, Senegal to understand the context of malaria in this region.
"Fagaru moo gën faju" ~ Wolof proverb
"Prevention is better than cure"
This wise Wolof proverb couldn't be truer than today when we consider the current challenges facing malaria control and elimination. Tremendous gains over the last few decades have been threatened by rising antimalarial drug and insecticide resistance. Just as the proverb implies, preventing one of world's deadliest infectious diseases is the ultimate goal. The need for a highly effective malaria vaccine as a tool in the toolbox for malaria elimination has never been more timely. In order to ensure that next generation malaria vaccines in development are maximally protective, we have to address the challenge of parasite diversity early and upfront.
Before we explore the approach, first we have to transport you to where we do our science, specifically, Kédougou, Senegal. This is a region located in the "KKT" region (Kédougou, Kolda, Tambacounda) in Senegal - a region of critical importance and a focal area for the PNLP (Programme National de Lutte contre le Paludisme). Despite declining malaria in many parts of the country, Kédougou remains the region with the highest malaria burden. It is here in this region that most of the malaria prevention activities are focused based on the disproportionately high malaria transmission intensity. Kédougou has a population of roughly 245,288, and in 2022 the official reported malaria cases were 89,093 in the region. The incidence rate in Kédougou is >250 per 1000 population per year, making it a highly malaria endemic zone by WHO metrics. (PNLP, Bulletin Epidémiologique Annuel 2022 de Paludisme au Sénégal).

Partnering with the community in Bandafassi, Kédougou, Senegal
In our previous study in this region (https://www.nature.com/articles/s41598-022-23929-9), through genomic surveillance approaches at 6 different clinic sites, our goal was to explore the extent of genetic diversity in PfRh5 - a promising new malaria vaccine candidate that had recently entered clinical trials. In this high endemic region, we identified novel variants in this target, and importantly, mutations that could potentially impact function. However the take home from this study is that while we can imply potential functional outcomes of the mutations identified in PfRh5, further experimental work was needed to fully assess the potential functional impacts of these SNPs in immune evasion in the presence of naturally acquired and vaccine-induced immune responses.
These early studies of genetic diversity in the region illustrated that this would be the ideal population to explore whether vaccines could work against very diverse parasites. In our current paper (https://rdcu.be/dXXny), we explore this very question - from the field. One way to assess the role of diverse parasites on immune neutralization - the best way to do this is to test parasites directly from patients to have a clear picture of activity in the face of the complex infections that are actually causing disease in the population of Kédougou. To do this, we have to take our cutting-edge approaches TO the field, basically setting up shop where malaria transmission is highest. Bringing the cutting-edge science to the disease endemic settings involves investing in field-based research stations that position us to perform these studies in remote regions.
station with the Gambia River and mountains in neighboring Guinea in the background.
However, this is an approach that takes year-round coordination, commitment, and communication at every level. To be successful it is important to us to build trust in the communities we serve. This involves frequent discussion, sharing of data, and soliciting advice and guidance from community members, local clinic staff, district, regional, and national medical officers. It is important that we build "roots, not parachutes" - a phrase coined by our respected colleagues (https://doi.org/10.1016%2Fj.cell.2016.06.029) , to emphasize the long term commitment that is required to truly do impactful science in disease endemic regions.
Meanwhile, back at the lab ...
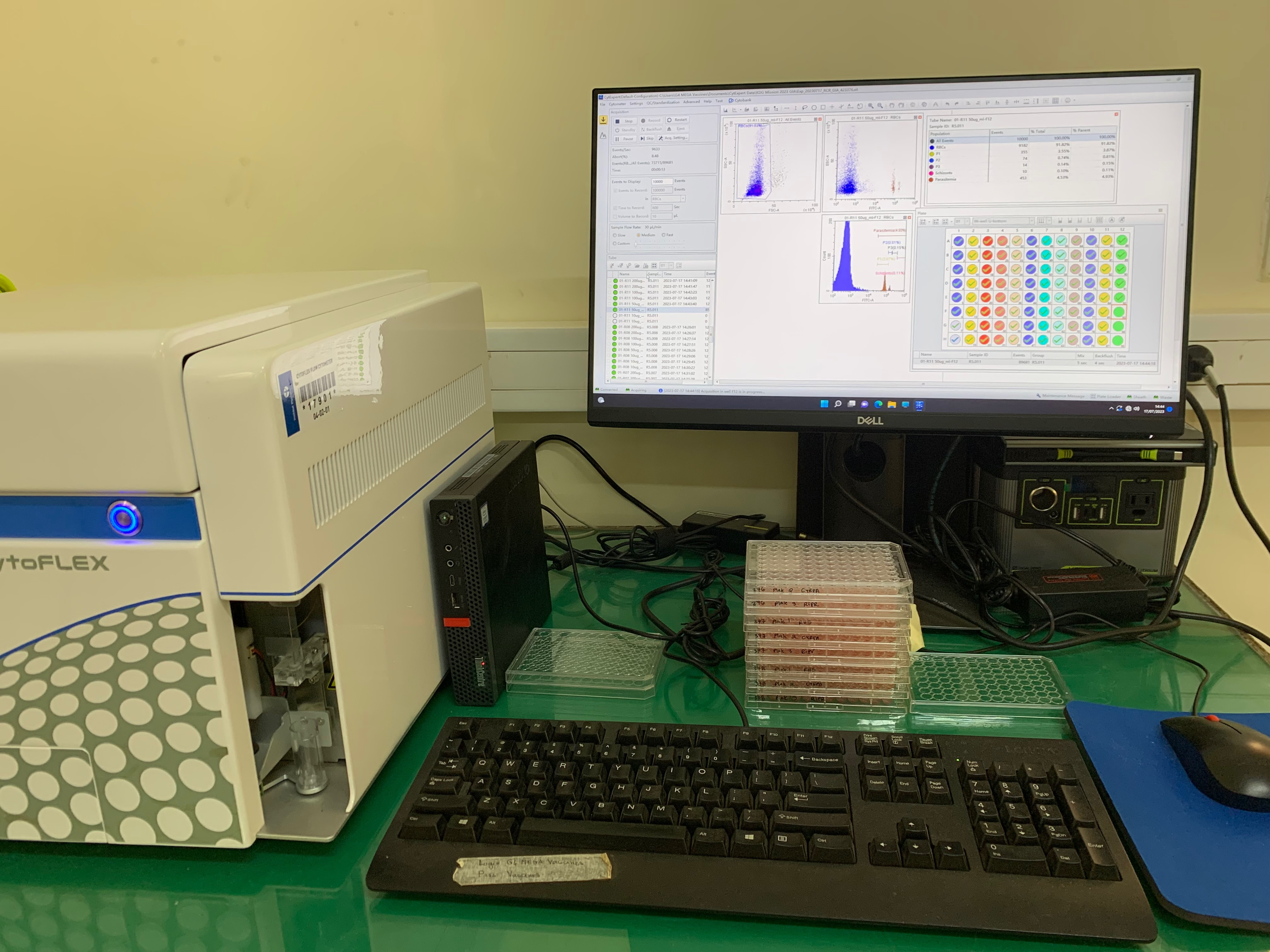
After participants have given their informed consent to participate in the study (no small feat given the diversity of languages spoken in the region - Pulaar, Bassari, Bedik, Diakhanké, and Malinké just to name a few), the team returns to the lab to start the sample processing and set up the experiments. We use an in vitro immune phenotyping assay called a GIA assay to help measure vaccine efficacy. The principle behind a GIA assay is that we mix antibodies from vaccinees from separately conducted clinical trials with clinical isolates (parasites from patients) and we measure the level of invasion of the parasites into red blood cells. We can calculate the degree of inhibition relative for our PffRh5 vaccine antibodies relative to naïve antibodies. This gives us our percent inhibition of invasion. This approach allows us to measure parasite invasion in a high throughput unbiased way using Flow cytometry.
%20rh5.png)
Testing the activity of anti-PfRH5 antibodies against clinical isolates IN the field.
Partially created with BioRender.com. Figure credit: Noemi Guerra, Art credit: Alyssa Agarwal
It's worth mentioning that we use a super tough and field-deployable flow cytometer (Beckman Coulter CytoFLEX). This sturdy unit has made multiple 740km trips to the field (1480km round trip) and is still going strong! A unique feature of this small but mighty cytometer is the ability for remote servicing through Team Viewer with Beckman service representatives in multiple regions of the world !
The first step of the experiment is preparing the antibody dilution plates and combinations, when evaluating antibody synergy. In addition to our test antibodies, we incorporate multiple internal control conditions to ensure that our experimental data is both internally controlled, standardized, and comparable day to day. The antibodies are precious so this is a step that requires focus and very careful pipetting. Once the dilution plates are prepared, we plate into the assay plates and finally add the parasites from participants. The parasites will grow and develop in the presence of the antibodies until the critical moment in the assay - when the merozoites burst from one infected cell and go searching for uninfected red cells to invade. This is the moment where the antibodies do their job - namely to block the parasites from invading the red blood cells, and this is precisely what we will measure when we harvest the experiment.

We harvest the experiment when all the parasites have re-invaded in our sentinel control wells. Then we wash and stain the experiment with SYBR Green, a dye that will bind DNA in the parasites, but not erythrocytes that do not have a nucleus. Again, more careful pipetting, washing, staining, washing and finally we are ready to read on the flow cytometer. Perhaps it goes without saying but these experiments require teamwork and coordination. Our approach is truly an all-hands-on-deck approach.

ex vivo GIA assays in the field

GIA assays in the field.
Besides the precision and hard work that goes into these experiments, working in the field brings its own unique challenges. Electricity is a constant challenge in rural areas and we have to ensure that our critical equipment is connected to surge protectors and battery back-ups to keep the science going. This way, when power outages do occur, the experiments can continue uninterrupted.

cutting-edge science in the field because the science must go on! Here, in the
middle of a power outage, assays continue with equipment connected to battery
backup as well as determination and positive team energy.
At last, the experiment is ready to run on the flow cytometer. We can gather data from 100,000 individual red blood cells per well in matter of seconds so we are truly able to generate high throughput and unbiased data which will ultimately allow us to answer the question - Do these Rh5 vaccinee antibodies protect equally well in the face of diverse parasites from Kédougou?
activity against malaria parasite invasion, in the field and in real-time.
So through all these challenges and hard work, as well as creative problem solving and innovation, what did we discover? Excitingly, our work provides the first compelling evidence of the susceptibility of P. falciparum clinical isolates to vaccine-induced mAbs targeting the leading blood-stage malaria vaccine candidate antigen PfRH5, as well as the additive interaction between antibodies with different GIA profiles. Moreover, although our data seem to highlight the lack of functional impact of the identified diversity in the study population, the results from our in-silico prediction of the functional impact of these polymorphisms on the parasites’ susceptibility warrant further biochemical and functional genetic studies to understand their contribution on the overall parasite phenotype. So the story continues ...

Our overall goal is to bring the evaluation of genetic diversity to the forefront of vaccine development and evaluation. With a challenge like malaria, we can't afford to cross our fingers and hope for the best. We have to tackle this challenge early and make sure that next-generation vaccines will work well against the broad diversity of P. falciparum isolates! And a critical part of this approach is empowering the next-generation of young African scientists to lead the way in the discovery, production, testing, and implementation of a highly effective vaccine for malaria.
The following is our Behind the Paper post in French, to broaden the reach of our story, to share with our francophone colleagues and partners, and to strive to overcome linguistic barriers to global health equity.
Voici notre article Behind the Paper en français, pour élargir la portée de notre histoire, pour la partager avec nos collègues et partenaires francophones et pour nous efforcer de surmonter les barrières linguistiques à l'équité en santé mondiale.
Les vaccins contre l'homologue 5 de la protéine de liaison aux réticulocytes de Plasmodium falciparum (PfRH5) ciblent le stade sanguin du cycle de vie du parasite. PfRH5 a le potentiel de déclencher la production d'anticorps transcendant la souche et a prouvé son efficacité à la fois dans les études précliniques et cliniques précoces. Les anticorps monoclonaux (mAbs) induits par le vaccin contre la PfRH5 ont montré des résultats prometteurs contre des souches de laboratoire de P. falciparum cultivées dans des zones géographiques distinctes. Ici, nous avons évalué l'impact fonctionnel des mAbs anti-PfRH5 induits par le vaccin sur des isolats cliniques de P. falciparum génétiquement plus diversifiés. Nos résultats actuels complètent les rapports antérieurs sur le potentiel transcendant la souche des mAbs anti-PfRH5 et constituent, à notre connaissance, le premier rapport sur la sensibilité des isolats cliniques de P. falciparum issus d'infections naturelles aux mAbs humains induits par le vaccin contre la PfRH5. Mais l'histoire ne s'arrête pas là ! Ici, nous vous emmenons dans les coulisses de nos travaux récents, et pour ce faire, nous devons d'abord vous amener à Kédougou, au Sénégal, pour comprendre le contexte du paludisme dans cette région.
"Fagaru moo gën faju" ~ Proverbe Wolof
"Mieux vaut prévenir que guérir"
Ce sage proverbe wolof ne pourrait pas être plus vrai qu'aujourd'hui lorsque nous considérons les défis actuels auxquels sont confrontés le contrôle et l'élimination du paludisme. Des progrès considérables ont été réalisés au cours des dernières décennies, mais ils sont menacés par l'augmentation de la résistance aux médicaments antipaludiques et aux insecticides. Comme le suggère le proverbe, la prévention de l'une des maladies infectieuses les plus meurtrières au monde est l'objectif ultime. Le besoin d'un vaccin antipaludique hautement efficace comme outil dans la boîte à outils pour l'élimination du paludisme n'a jamais été aussi opportun. Afin de garantir que les vaccins antipaludiques de nouvelle génération en cours de développement offrent une protection maximale, nous devons relever le défi de la diversité parasitaire dès le début et en amont.
Avant d'explorer l'approche, nous devons d'abord vous transporter là où nous faisons notre science, plus précisément à Kédougou, au Sénégal. Il s'agit d'une région située dans la zone "KKT" (Kédougou, Kolda, Tambacounda) au Sénégal - une région d'une importance cruciale et une zone focale pour le PNLP (Programme National de Lutte contre le Paludisme). Malgré le déclin du paludisme dans de nombreuses régions du pays, Kédougou reste la région avec le fardeau le plus élevé de paludisme. C'est dans cette région que se concentrent la plupart des activités de prévention du paludisme en raison de l'intensité disproportionnée de la transmission du paludisme. Kédougou compte environ 245 288 habitants et, en 2022, les cas de paludisme officiellement signalés étaient de 89 093 dans la région. Le taux d'incidence à Kédougou est supérieur à 250 pour 1 000 habitants par an, ce qui en fait une zone de forte endémie palustre selon les mesures de l'OMS. (PNLP, Bulletin Epidémiologique Annuel 2022 de Paludisme au Sénégal).

Partenariat avec la communauté de Bandafassi, Kédougou, Sénégal
Dans notre étude précédente dans cette région (https://www.nature.com/articles/s41598-022-23929-9), par le biais d'approches de surveillance génomique sur 6 sites cliniques différents, notre objectif était d'explorer l'étendue de la diversité génétique sur PfRh5 - un nouveau candidat vaccin prometteur contre le paludisme qui venait d'entrer en essais cliniques. Dans cette région à forte endémie, nous avons identifié de nouvelles variantes dans cette cible et, surtout, des mutations qui pourraient potentiellement avoir un impact sur sa fonction. Cependant, le point à retenir de cette étude est que, bien que nous puissions supposer des effets fonctionnels potentiels des mutations identifiées dans PfRh5, des travaux expérimentaux supplémentaires étaient nécessaires pour évaluer pleinement les impacts fonctionnels potentiels de ces SNP dans l'évasion immunitaire en présence de réponses immunitaires naturellement acquises et induites par le vaccin.
Ces premières études sur la diversité génétique dans la région ont montré qu'il s'agirait de la population idéale pour explorer si les vaccins pouvaient fonctionner contre des parasites très divers. Dans notre article actuel (https://rdcu.be/dXXny), nous explorons cette même question - depuis le terrain. Le meilleur moyen d'évaluer le rôle de la diversité parasitaire sur la neutralisation immunitaire est de tester directement les parasites des patients afin d'avoir une image claire de l'activité face aux infections complexes qui causent réellement la maladie dans la population de Kédougou. Pour ce faire, nous devons porter nos approches de pointe sur le terrain, en nous installant essentiellement là où la transmission du paludisme est la plus élevée. Faire venir la science de pointe dans les zones d'endémie de la maladie nécessite d’investir dans des stations de recherche sur le terrain qui nous permettent de réaliser ces études dans des régions éloignées.
Gambie et les montagnes de la Guinée voisine en arrière-plan.
Cependant, il s'agit d'une approche qui nécessite une coordination, un engagement et une communication tout au long de l'année à tous les niveaux. Pour réussir, il est important pour nous d'instaurer la confiance dans les communautés que nous servons. Cela implique des discussions fréquentes, le partage de données et la sollicitation de conseils et d'orientations auprès des membres de la communauté, du personnel des cliniques locales, des médecins du district, de la région et du pays. Il est important que nous construisions des « racines, pas des parachutes » - une expression inventée par nos estimés collègues (https://doi.org/10.1016%2Fj.cell.2016.06.029) , pour souligner l'engagement à long terme nécessaire pour réaliser une véritable recherche ayant un impact dans les régions d'endémie des maladies.
Pendant ce temps, de retour au laboratoire...
Une fois que les participants ont donné leur consentement éclairé pour participer à l'étude (ce qui n'est pas une mince affaire étant donné la diversité des langues parlées dans la région - Pulaar, Bassari, Bedik, Diakhanké et Malinké pour n'en citer que quelques-unes), l'équipe retourne au laboratoire pour commencer le traitement des échantillons et mettre en place les expériences. Nous utilisons un test de phénotypage immunitaire in vitro appelé test GIA pour aider à mesurer l'efficacité du vaccin. Le principe derrière un test GIA est que nous mélangeons des anticorps de vaccinés issus d'essais cliniques menés séparément avec des isolats cliniques (parasites de patients) et nous mesurons le niveau d'invasion des parasites dans les globules rouges. Nous pouvons calculer le degré d'inhibition relatif de nos anticorps vaccinaux PffRh5 par rapport aux anticorps naïfs. Cela nous donne notre pourcentage d'inhibition de l'invasion. Cette approche nous permet de mesurer l'invasion parasitaire de manière impartiale à haut débit en utilisant la cytométrie de flux.
%20rh5.png)
Test de l'activité des anticorps anti-PfRH5 contre des isolats cliniques sur le terrain. Créé partiellement avec BioRender.com. Crédit de la figure : Noemi Guerra, Crédit artistique : Alyssa Agarwal
Il convient de mentionner que nous utilisons un cytomètre de flux ultra-résistant et déployable sur le terrain (Beckman Coulter CytoFLEX). Cette unité robuste a effectué plusieurs voyages de 740 km sur le terrain (1 480 km aller-retour) et fonctionne toujours aussi bien ! Une caractéristique unique de ce cytomètre petit mais puissant est la possibilité d'entretien à distance via Team Viewer avec des représentants du service Beckman Coulter dans plusieurs régions du monde !
La première étape de l'expérience consiste à préparer les plaques de dilution et les combinaisons d'anticorps, lors de l'évaluation de la synergie des anticorps. En plus de nos anticorps de test, nous incorporons plusieurs conditions de contrôle interne pour garantir que nos données expérimentales sont à la fois contrôlées en interne, standardisées et comparables au jour le jour. Les anticorps sont précieux, c'est donc une étape qui nécessite de la concentration et un pipetage très minutieux. Une fois les plaques de dilution préparées, nous les plaçons dans les plaques d'essai et ajoutons enfin les parasites des participants. Les parasites se développeront en présence des anticorps jusqu'au moment critique de l'essai, lorsque les mérozoïtes éclatent d'une cellule infectée et partent à la recherche de globules rouges non infectés à envahir. C'est à ce moment que les anticorps font leur travail, à savoir empêcher les parasites d'envahir les globules rouges, et c'est précisément ce que nous mesurerons lors de la récolte de l'expérience.

Nous récoltons l'expérience lorsque tous les parasites dans nos puits de contrôle sentinelle ont réenvahi. Ensuite, nous lavons et marquons les globules rouges infectés avec du SYBR Green, un marqueur qui va se lier à l'ADN des parasites, mais pas aux globules rouges qui sont dépourvus de noyau. Une fois de plus, pipetage, lavage, marquage, lavage plus minutieux et enfin nous sommes prêts à lire sur le cytomètre de flux. Peut-être va-t-il sans dire que ces expériences nécessitent un travail d'équipe et une coordination. Notre approche est vraiment une approche où tout le monde est sur le pont.

méticuleuse des essais GIA ex vivo réussis sur le terrain

méticuleuse des essais GIA réussis sur le terrain
Outre la précision et le travail acharné qui sont nécessaires à ces expériences, le travail sur le terrain apporte ses propres défis uniques. L'électricité est un défi constant dans les zones rurales et nous devons nous assurer que notre équipement critique est connecté aux régulateurs et aux onduleurs pour que la science continue. De cette façon, lorsque des pannes de courant se produisent, les expériences peuvent se poursuivre sans interruption.

Vous devez être prêt à tout lorsque vous effectuez une science de pointe sur le terrain, car la science
doit continuer ! Ici, au milieu d'une panne de courant, les analyses se poursuivent avec un équipement
connecté à une batterie de secours ainsi qu'à la détermination et à l'énergie positive de l'équipe.
Enfin, l'expérience est prête à être exécutée sur le cytomètre de flux. Nous pouvons recueillir des données à partir de 100 000 globules rouges individuels par puits en quelques secondes, ce qui nous permet de générer des données à haut débit et impartiales qui nous permettront finalement de répondre à la question : ces anticorps vaccinés Rh5 protègent-ils aussi bien face à divers parasites de Kédougou ?

neutralisants contre l'invasion du parasite du paludisme, sur le terrain et en temps réel
Alors, malgré tous ces défis et ce travail acharné, ainsi que grâce à la résolution créative des problèmes et à l’innovation, qu’avons-nous découvert ? Il est passionnant de constater que notre travail fournit la première preuve convaincante de la sensibilité des isolats cliniques de P. falciparum aux anticorps monoclonaux induits par le vaccin ciblant l’antigène candidat principal du vaccin contre le paludisme au stade sanguin PfRH5, ainsi que de l’interaction additive entre les anticorps ayant différents profils GIA. De plus, bien que nos données semblent mettre en évidence l’absence d’impact fonctionnel de la diversité identifiée dans la population étudiée, les résultats de notre prédiction in silico de l’impact fonctionnel de ces polymorphismes sur la sensibilité des parasites justifient la nécessité d’entreperendre d’autres études biochimiques et de génétiques fonctionnelles pour comprendre leur contribution sur le phénotype global du parasite. L’histoire continue donc…

Notre objectif global est de placer l’évaluation de la diversité génétique au premier plan du développement et de l’évaluation des vaccins. Face à un défi comme le paludisme, nous ne pouvons pas nous permettre de croiser les doigts et d’espérer le meilleur. Nous devons relever ce défi dès le début et nous assurer que les vaccins de nouvelle génération seront efficaces contre la grande diversité des isolats de P. falciparum ! Et un élément essentiel de cette approche consiste à donner à la prochaine génération de jeunes scientifiques africains les moyens de montrer la voie dans la découverte, la production, les tests et la mise en œuvre d'un vaccin hautement efficace contre le paludisme.
Follow the Topic
-
npj Vaccines

A multidisciplinary journal that is dedicated to publishing the finest and high-quality research and development on human and veterinary vaccines.
Related Collections
With Collections, you can get published faster and increase your visibility.
Lipid nanoparticle (LNP)-adjuvanted vaccines
Publishing Model: Open Access
Deadline: Feb 19, 2026
Therapeutic HPV vaccines
Publishing Model: Open Access
Deadline: Jun 30, 2026




Please sign in or register for FREE
If you are a registered user on Research Communities by Springer Nature, please sign in